微生物研究室 上野です。
当研究室は細菌などの微生物に関する検査だけでなく,病理検査も担当しています。病理検査では,病気の馬より採取した臓器・組織から作製した標本を用い,病変の形態学的な評価を行います。
今日は一般的な病理組織標本~ホルマリン固定パラフィン包埋(ほうまい)標本の作製方法について2回にわたり紹介いたします。
固定
採取された組織は,一般的には薬品による固定(化学的固定)が施されます。固定の主な目的は採取時の形状を保つこと,すなわち「自家融解や細菌による腐敗を防止すること」や「組織や細胞のタンパク質を変化させて形態や内部に含まれる物質を保存すること」にあります。通常はホルマリン(ホルムアルデヒド水溶液)を用いますが,目的によっては高濃度のアルコールも使用します。
切り出し
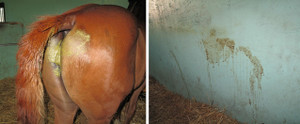
固定後の組織から検査に必要な部分を選択し,標本作製に適した大きさ・形にナイフで切り取ります(図1,2)。骨などの石灰化した組織は,そのままでは硬すぎて切ることができないので,カルシウムなどを取り除くための脱灰(だっかい)処理を事前に行います。
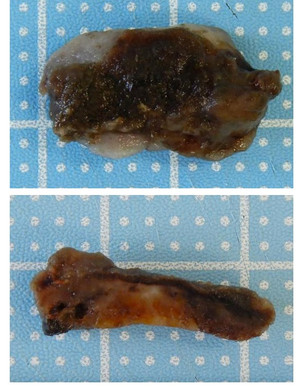
図1 ホルマリン固定後の採取組織(鼻にできたイボ)
上:表面からみたところ。
下:縦断面。この面を顕微鏡観察します。
 図2 サンプル処理用カセット *蓋を外しています
図2 サンプル処理用カセット *蓋を外しています
取り間違えが無いよう,サンプル毎に個別のカセットに入れ処理を進めます。
包埋(ほうまい)
顕微鏡観察のためには極めて薄く組織を切らなければなりません。通常私たちは3-5 μm(1000分の3-5 mm)の標本を作製しています。固定処理でもある程度の“硬さ“は生じるのですが,レバニラ炒めのレバー程度の硬さであるので,そのままでは顕微鏡観察ができるほど薄く切ることはできません。そこで組織に適度な硬さを与えるための物質~パラフィン(蝋)を組織に浸透させます。パラフィンは水をはじく性質があり,固定後の状態のままでは組織に浸透しないので,アルコールによる脱水→アルコールとパラフィンの両者に親和性のある物質(キシレン等)による中間処理→溶融パラフィンの浸透と手順を進めます。細かくは数時間おきに十数段階の手順を要しますが,専用の機械が自動的に処理してくれます(図3)。パラフィン浸透が終わった組織は,溶融パラフィンと共に冷やし固めてブロック状にします(図4,5)。
 図3 自動包埋装置
図3 自動包埋装置
 図4 パラフィン浸透が終わった組織
図4 パラフィン浸透が終わった組織
溶融パラフィンと共に所定の型枠に入れて冷やします。
 図5 パラフィンブロック
図5 パラフィンブロック
冷やし固める途中で台座(サンプル処理用カセットを流用)を取り付けます。
*次回はパラフィン浸透組織の薄切(はくせつ)と染色方法についてご紹介します。
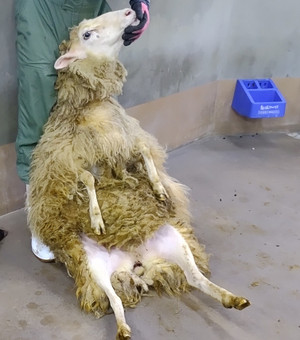



 赤で囲まれた部分が腫れている屈腱部です。反対の足に比べて太くなっているのがわかりますか?
赤で囲まれた部分が腫れている屈腱部です。反対の足に比べて太くなっているのがわかりますか?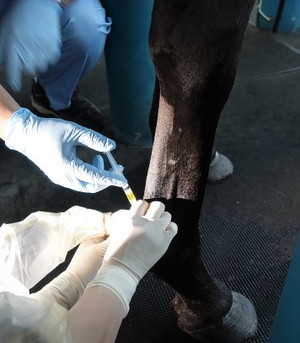 腫れている部分にPRP(黄色い液体)を注射器で注入しています。
腫れている部分にPRP(黄色い液体)を注射器で注入しています。
 図2 サンプル処理用カセット *蓋を外しています
図2 サンプル処理用カセット *蓋を外しています 図3 自動包埋装置
図3 自動包埋装置 図4 パラフィン浸透が終わった組織
図4 パラフィン浸透が終わった組織 図5 パラフィンブロック
図5 パラフィンブロック